上海华奥泰生物药业股份有限公司(以下简称“华奥泰”)收到美国FDA通知,同意公司自主研发的抗PD-L1/TIGIT双抗HB0036项目进入临床试验,这也是华奥泰生物第二款获得FDA批准进入临床的双抗项目(第一款是PD-L1/VEGF双抗项目)。HB0036为全球首个经FDA批准进入临床的靶向PD-L1和TIGIT这两个关键免疫检查点的双特异性抗体,华奥泰总经理朱向阳博士对此表示赞赏与期待。他认为综合HB0036分子自身优异的CMC特性、良好的协同抗肿瘤作用以及罗氏Atezolizumab和Tiragolumab联合令人振奋的临床结果来看,(罗氏12月10日在ESMO大会更新TIGIT+PD-L1联用最新数据显示,其一线治疗NSCLC,PD-L1高表达人群疾病进展或死亡风险降低71%),HB0036有望在临床上为广大肿瘤患者、特别是那些PD-1/PD-L1治疗耐受或无效的患者带来获益;并希望HB0036尽早启动临床研究,为广大患者带去福音。
关于HB0036
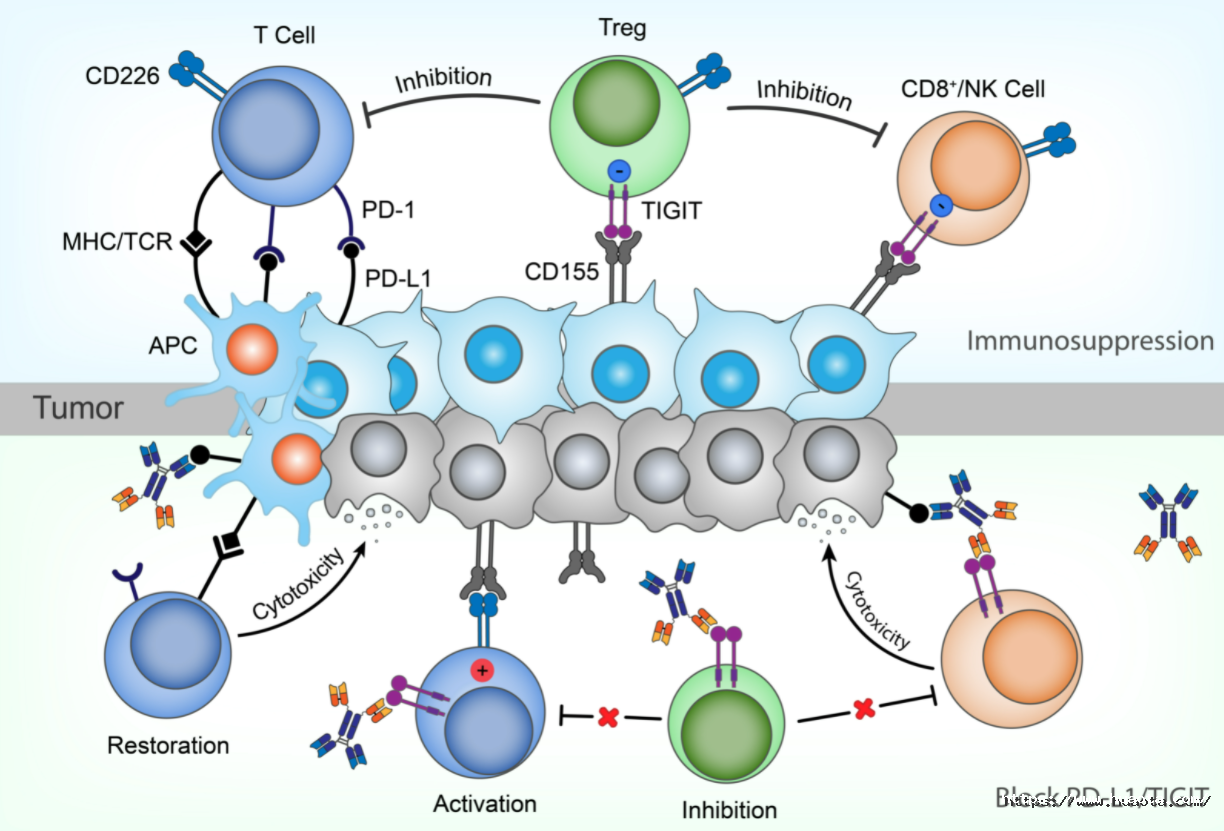
HB0036是基于华奥泰自主开发的多能抗体平台开发的第二款双特异性抗体,能高特异性的与PD-L1和TIGIT结合,具有协同抗肿瘤作用,阻断PD-1/PD-L1和TIGIT/CD155这两条信号通路的信号传导,从而解除这两条信号通路介导的免疫抑制作用,重新激活细胞毒性T淋巴细胞和NK细胞对肿瘤细胞的杀伤作用。此外,由于HB0036保留了PD-L1和TIGIT所介导的ADCC作用,可进一步通过ADCC作用杀伤肿瘤细胞和Treg细胞,增强抗肿瘤效果。
临床前研究表明HB0036的抗肿瘤效果优于单药组、与两单药联合组相当;非人灵长类动物中开展的临床前药代动力学结果显示HB0036呈线性药代特征,具有较长的半衰期和令人满意的药代动力学特性;毒理研究显示HB0036安全性和耐受性良好,有巨大的成为新一代肿瘤治疗药物的潜力。
竞争格局
目前全球范围内尚无同靶点药物上市,临床进展最快的同类药物是罗氏开发的抗PD-L1单抗Atezolizumab和抗TIGIT单抗Tiragolumab的联用,2021年1月FDA授予罗氏Atezolizumab联合Tiragolumab一线治疗NSCLC突破性治疗药物(BTD)认定。目前除联用机制外,PD-1/TIGIT双抗的研究也有众多企业正在进行中。